پودر استخوان در بازسازی بافت هدایتشده (GTR): راهنمای جامع و بهروز
- admin
- دستهبندی نشده

از دست رفتن بافتهای پریودنتال یکی از چالشهای اساسی در درمان بیماریهای لثه و جراحیهای دندانی است. با پیشرفتهای علوم بیولوژی و مواد دندانی، روشهای بازسازی هدایتشده بافت (Guided Tissue Regeneration: GTR) بهعنوان یکی از مؤثرترین تکنیکها برای بازگرداندن ساختار و عملکرد طبیعی بافت پریودنتال معرفی شدهاند. در این روش با استفاده از غشاهای مانع و مواد جایگزین استخوانی، شرایطی فراهم میشود تا سلولهای پریودنتال بتوانند در ناحیه تخریبشده رشد کنند و بافت از بین رفته را بازسازی نمایند.
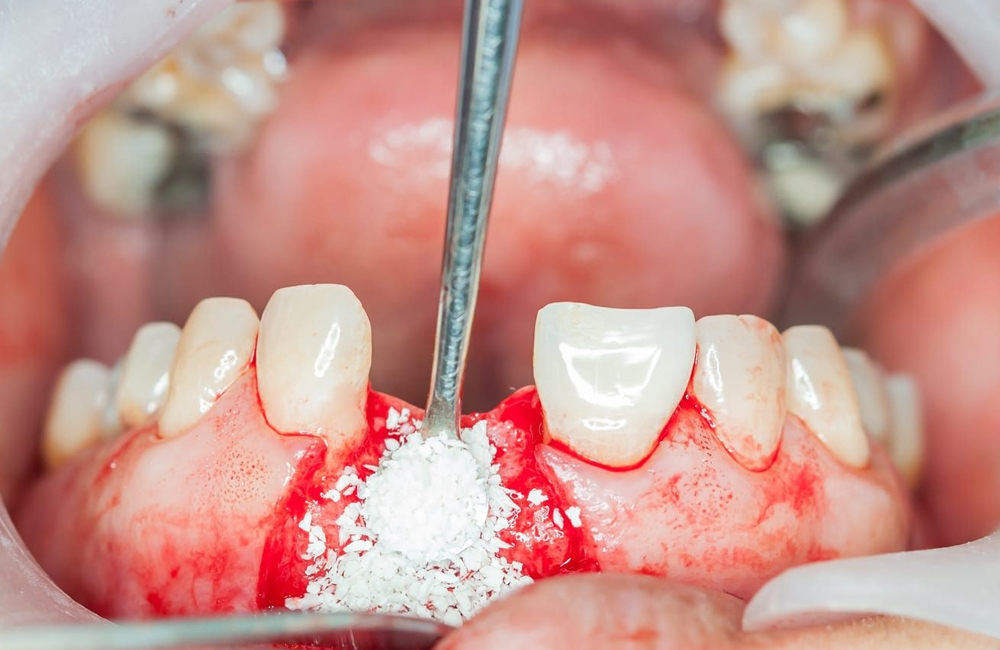
در این میان، پودر استخوان نقش کلیدی در پرکردن نقصهای استخوانی و تسهیل تشکیل استخوان جدید دارد. شناخت ترکیب، انواع و مکانیسم عملکرد پودر استخوان در فرآیند GTR برای دانشجویان و دندانپزشکان اهمیت زیادی دارد؛ زیرا انتخاب نوع مناسب پودر میتواند تأثیر مستقیمی بر نتایج درمانی داشته باشد.
برای اجرای موفق GTR، دو جزء اصلی مورد نیاز است:
غشا (Membrane):
وظیفهی اصلی آن جدا کردن بافت نرم از ناحیه بازسازی است. غشاها میتوانند قابل جذب (resorbable) یا غیرقابل جذب (non-resorbable) باشند.مواد پرکننده استخوانی (Bone Grafts):
این مواد، محیطی سهبعدی و زیستسازگار برای رشد استخوان جدید ایجاد میکنند و میتوانند خواص استئوکانداکتیو (Osteoconductive)، استئوایندوکتیو (Osteoinductive) یا استئوژِنیک (Osteogenic) داشته باشند.
پودر استخوان بهعنوان یکی از رایجترین و مؤثرترین انواع مواد پرکننده، جایگاه ویژهای در این میان دارد.
مبانی نظری تکنیک GTR
تکنیک GTR بر پایهی یک اصل ساده اما علمی استوار است:
جداسازی انتخابی سلولی. در شرایط طبیعی، پس از برداشت بافت یا از بین رفتن استخوان آلوئول، سلولهای اپیتلیالی و بافت همبند با سرعت بیشتری نسبت به سلولهای استخوانی و لیگامان پریودنتال مهاجرت میکنند. این امر منجر به پرشدن سریع ناحیه با بافت نرم و در نتیجه، مانع تشکیل استخوان جدید میشود.
در GTR، با استفاده از غشاهای مانع (Barrier Membranes) از ورود سلولهای نرم به ناحیه بازسازی جلوگیری شده و فرصت کافی برای سلولهای استخوانساز (استئوبلاستها) و فیبروبلاستهای لیگامان پریودنتال فراهم میشود تا در محیطی کنترلشده رشد کنند.
پودر استخوان: ترکیب، انواع و مکانیسم عملکرد
پودر استخوان (Bone Powder or Bone Graft Material) در اصل ترکیبی از مواد معدنی و آلی استخوانی است که به شکل ذرات ریز فرآوری شده و برای پر کردن نقصهای استخوانی استفاده میشود. عملکرد آن در بازسازی استخوانی وابسته به سه مکانیزم زیستی زیر است:
Osteoconduction: ایجاد چارچوبی (اسکافولد) برای رشد سلولهای استخوانساز.
Osteoinduction: تحریک تمایز سلولهای بنیادی به سلولهای استخوانی.
Osteogenesis: مشارکت مستقیم سلولهای زنده در تشکیل استخوان جدید (در گرافتهای اتولوگ).
انواع پودر استخوان:
انواع پودر استخوان:
اتولوگ (Autograft):
بهدستآمده از خود بیمار، معمولاً از نواحی فک یا استخوان ایلیاک. این نوع بهترین خاصیت زیستی را دارد چون هم استئوژنیک و هم ایندوکتیو است.
مزایا: زیستسازگاری عالی، عدم رد پیوند
معایب: نیاز به جراحی دوم، محدودیت حجمآلوگرافت (Allograft):
استخوان بهدستآمده از فرد دیگر (بانک استخوان) که از نظر آنتیژنی غیرفعال شده است.
دو نوع اصلی دارد:Freeze-Dried Bone Allograft (FDBA)
Demineralized Freeze-Dried Bone Allograft (DFDBA)
مزایا: حجم زیاد، عدم نیاز به جراحی دوم
معایب: احتمال اندک انتقال بیماری و کاهش خواص بیولوژیک
زنوگرافت (Xenograft):
استخوان حیوانی (معمولاً گاوی یا خوکی) که بهطور کامل از نظر پروتئینی پاکسازی شده است.
مزایا: حجم فراوان، خواص استئوکانداکتیو خوب
معایب: نبود سلول زنده و احتمال واکنش ایمنی جزئیآلوپلاست (Alloplast):
مواد سنتزی مانند هیدروکسیآپاتیت، β-TCP (تریکلسیم فسفات) یا بیوگلاس.
مزایا: زیستسازگار، کنترلپذیر از نظر اندازه و شکل
معایب: فاقد خواص ایندوکتیو یا ژنتیکی واقعی
نقش پودر استخوان در فرایند GTR
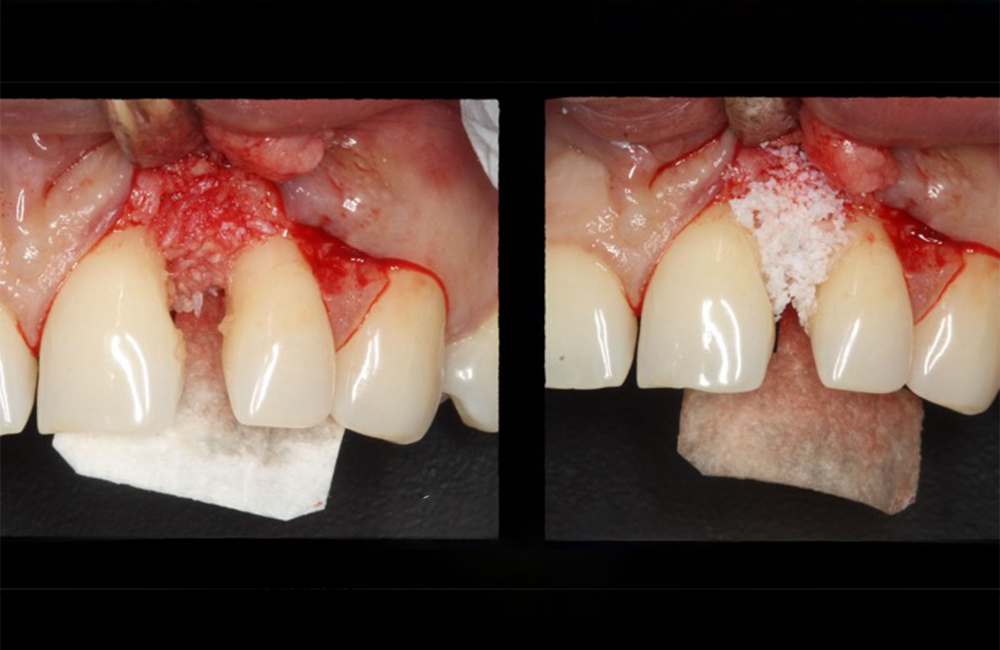
در تکنیک GTR، پودر استخوان معمولاً بهعنوان فیلر (Filler) یا اسکافولد (Scaffold) در زیر غشا قرار میگیرد. نقشهای اصلی آن عبارتاند از:
حفظ فضا (Space Maintenance):
یکی از چالشهای GTR جلوگیری از فروپاشی غشا و تماس آن با بافت نرم است. پودر استخوان با پر کردن حفره، ساختار سهبعدی مورد نیاز برای حفظ فضا را فراهم میکند.القا و هدایت رشد استخوانی:
در حضور پودر استخوان، سلولهای استئوبلاست روی سطح ذرات مینشینند و ماتریکس استخوانی جدید تولید میکنند. برخی انواع پودر، مانند DFDBA، حاوی پروتئینهای القاکننده استخوان (BMPs) هستند که تمایز سلولی را تحریک میکند.افزایش ثبات مکانیکی در ناحیه جراحی:
پودر استخوان با پر کردن نقص استخوانی، از جابهجایی غشا و فروپاشی ساختار بازسازیشده جلوگیری میکند.افزایش حجم استخوان در نواحی تحلیلرفته:
بهویژه در جراحیهای ایمپلنت، استفاده از پودر استخوان در GTR باعث افزایش ضخامت و ارتفاع استخوان آلوئول میشود و شرایط مطلوب برای کاشت ایمپلنت فراهم میآورد.

مبانی نظری تکنیک GTR
تکنیک GTR بر پایهی یک اصل ساده اما علمی استوار است:
جداسازی انتخابی سلولی. در شرایط طبیعی، پس از برداشت بافت یا از بین رفتن استخوان آلوئول، سلولهای اپیتلیالی و بافت همبند با سرعت بیشتری نسبت به سلولهای استخوانی و لیگامان پریودنتال مهاجرت میکنند. این امر منجر به پرشدن سریع ناحیه با بافت نرم و در نتیجه، مانع تشکیل استخوان جدید میشود.
در GTR، با استفاده از غشاهای مانع (Barrier Membranes) از ورود سلولهای نرم به ناحیه بازسازی جلوگیری شده و فرصت کافی برای سلولهای استخوانساز (استئوبلاستها) و فیبروبلاستهای لیگامان پریودنتال فراهم میشود تا در محیطی کنترلشده رشد کنند.
شواهد بالینی و مطالعات پژوهشی
مطالعات متعددی نقش حیاتی پودر استخوان را در موفقیت GTR تأیید کردهاند. برای مثال، پژوهشهای Buser et al. و Mellonig نشان دادهاند که استفاده از پودر استخوان همراه با غشا در ضایعات استخوانی عمودی (intrabony defects) میزان بازسازی استخوان و اتصال کلینیکی را بهطور معناداری افزایش میدهد.
در بررسیهای هیستولوژیک، نواحی درمانشده با پودر استخوان، تراکم استخوان جدید بیشتری را نسبت به نواحی بدون گرافت نشان دادهاند. همچنین ترکیب پودر استخوان با غشاهای کلاژنی منجر به تسریع بازسازی و پایداری بیشتر نتایج در بلندمدت میشود.
| نوع پودر استخوان | خواص زیستی | مزایا | معایب | کاربرد توصیه شده |
|---|---|---|---|---|
| Autograft | استئوژنیک + ایندوکتیو + کانداکتیو | بهترین نتیجه بالینی | محدودیت حجم، نیاز به برداشت | نقصهای بزرگ و جراحیهای حساس |
| Allograft | ایندوکتیو + کانداکتیو | سهولت استفاده، حجم زیاد | احتمال اندک واکنش ایمنی | پریودنتال و ایمپلنت |
| Xenogra | کانداکتیو | پایداری بالا، حجم فراوان | سرعت جذب پایین | افزایش حجم استخوان فک |
| Alloplast | کانداکتیو مصنوعی | زیستسازگار، ارزان | فاقد فاکتورهای رشد | پرکردن نقصهای کوچک یا ترکیبی |
در اغلب پروتکلهای امروزی، ترکیب زنوگرافت + غشای قابل جذب رایجترین انتخاب است؛ چرا که توازن مناسبی میان پایداری، سهولت استفاده و نتایج بالینی ارائه میدهد.
چالشها و ملاحظات بالینی
اگرچه استفاده از پودر استخوان در GTR نتایج مطلوبی دارد، اما چند نکتهی بالینی باید مورد توجه قرار گیرد:
آلودگی حین جراحی: محیط جراحی باید کاملاً استریل باشد تا از عفونت و تحلیل استخوان جلوگیری شود.
انتخاب نوع پودر متناسب با نوع ضایعه: در ضایعات محدود استخوانی، گرافتهای سنتزی کافیاند، ولی در نقصهای گسترده، آلوگرافت یا اتوگرافت ارجح است.
ثبات بافت نرم و بخیه مناسب: غشای روی پودر باید بهخوبی بافت نرم را پوشش دهد تا تماس با دهان و آلودگی رخ ندهد.
مدیریت جذب پودر: برخی پودرها جذب آهسته دارند که ممکن است باعث تأخیر در تشکیل استخوان جدید شوند. انتخاب نوع مناسب با توجه به سرعت بازسازی حیاتی است.

مبانی نظری تکنیک GTR
تکنیک GTR بر پایهی یک اصل ساده اما علمی استوار است:
جداسازی انتخابی سلولی. در شرایط طبیعی، پس از برداشت بافت یا از بین رفتن استخوان آلوئول، سلولهای اپیتلیالی و بافت همبند با سرعت بیشتری نسبت به سلولهای استخوانی و لیگامان پریودنتال مهاجرت میکنند. این امر منجر به پرشدن سریع ناحیه با بافت نرم و در نتیجه، مانع تشکیل استخوان جدید میشود.
در GTR، با استفاده از غشاهای مانع (Barrier Membranes) از ورود سلولهای نرم به ناحیه بازسازی جلوگیری شده و فرصت کافی برای سلولهای استخوانساز (استئوبلاستها) و فیبروبلاستهای لیگامان پریودنتال فراهم میشود تا در محیطی کنترلشده رشد کنند.
چالشها و ملاحظات بالینی
تحقیقات جدید در حوزه مهندسی بافت (Tissue Engineering) بهسمت استفاده از پودر استخوانهای هوشمند پیش میرود؛ موادی که با نانوذرات زیستفعال، پپتیدهای القاکننده استخوان یا سلولهای بنیادی مزانشیمی (MSCs) ترکیب میشوند. این نسل جدید از گرافتها میتواند علاوه بر ایجاد ساختار فیزیکی، فرآیند بازسازی بیولوژیکی را نیز فعالانه تحریک کند.
همچنین توسعه غشاهای زیستفعال که با پودر استخوان تعامل دارند، میتواند کارایی GTR را چند برابر افزایش دهد. در آینده، انتظار میرود ترکیب پودر استخوان با فناوریهای نوین مانند بیوپرینتینگ سهبعدی و هیدروژلهای زیستفعال مسیر جدیدی برای بازسازی استخوانهای فک و صورت بگشاید.
نتیجهگیری
پودر استخوان بهعنوان یکی از اجزای اصلی تکنیک GTR، نقشی اساسی در بازسازی بافتهای پریودنتال و استخوانی دارد. این ماده با فراهم کردن بستری فیزیکی و بیولوژیکی مناسب، موجب تسهیل رشد استخوان جدید و افزایش موفقیت درمانهای پریودنتال، ایمپلنت و جراحیهای ترمیمی میشود.
انتخاب آگاهانه نوع پودر استخوان با توجه به شرایط بیمار، نوع ضایعه و اهداف درمانی، کلید اصلی دستیابی به نتایج مطلوب در بازسازی هدایتشده بافت است.